恩维达®胃癌和胃食管结合部癌适应症获孤儿药资格认定
2025年12月18日,北京,思路迪医药(3D Medicines Inc.,股票代码:1244.HK)宣布,旗下商业化产品恩维达®(恩沃利单抗注射液)针对胃癌和胃食管结合部癌适应症正式获得孤儿药资格认定(Orphan Drug Designation, ODD), 恩维达®继胆管癌和软组织肉瘤适应症后成功获批的第三个孤儿药适应症。此次获批基于,本公司开展的恩维达®晚期胃/食管胃结合部腺癌的Ⅱ期临床研究中已展现出明确的抗肿瘤疗效,其联合FOLFOX方案的客观缓解率(ORR)达60%,疾病控制率(DCR)高达100%,且安全性与耐受性良好,无导致治疗终止或死亡的不良事件发生。
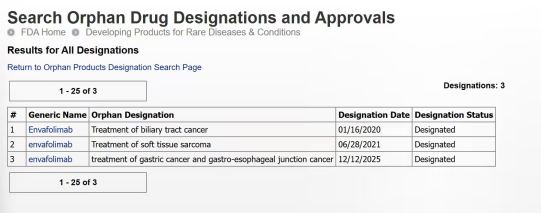
此次孤儿药资格认定是基于相关监管机构对罕见疾病治疗药物的严格评审标准。根据《孤儿药法案》定义,孤儿药是用于治疗、预防或诊断影响人数较少的罕见疾病的药物,对于胃癌和胃食管结合部癌适应症这一特定适应症,其适用的患者群体符合罕见疾病的界定要求。获得该资格认定后,恩维达®在后续的临床开发与商业化进程中将享有一系列政策支持,包括临床研究费用税收减免、药品获批后为期7年的市场独占权、免除新药申请相关费用等,这将显著加速其在该适应症领域的研发推进与市场落地效率。
从临床价值与市场意义来看,此次获批具有多重价值。一方面,胃癌作为全球范围内高发的恶性肿瘤之一,部分亚型患者治疗手段有限、预后较差,存在巨大的未被满足的医疗需求。此次孤儿药资格的获批,将推动这一联合治疗方案的进一步研发,为胃癌患者提供更有效的免疫治疗选择。另一方面,这一认定进一步丰富了恩维达®的适应症布局,为恩维达®的海外授权提供更多机会,销售预期提供上升空间
恩维达®作为全球首个上市的皮下注射PD-L1抑制剂,凭借其独特的分子设计与给药方式,在有效性、安全性、便利性及依从性上均展现出显著优势。与传统静脉注射PD-(L)1抗体药物不同,恩维达®采用皮下注射方式,30秒内即可完成给药,极大地简化了治疗流程,有效降低了患者就医频率与医疗成本,尤其适用于体弱、高龄及存在静脉输注反应风险的患者群体。
此次恩维达®胃癌和胃食管结合部癌适应症适应症孤儿药资格的获批,是公司在肿瘤治疗领域的又一重要里程碑。未来,公司将充分利用孤儿药相关政策支持,加速推进恩维达®在该适应症领域的临床研究与商业化进程,同时持续深耕创新药研发,探索更多肿瘤治疗的新方案,为全球肿瘤患者带来更多希望。
热门文章

请咨询我们