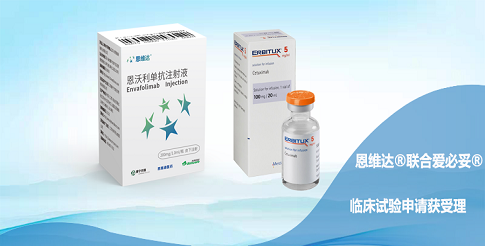
恩维达®获批两周给药方案,大幅提高患者用药便捷性
中国北京,2022年8月19日—思路迪医药(3D Medicines),宣布其首个商业化产品--全球首款皮下注射PD-L1抑制剂恩维达®,“新增300mg每两周给药一次”的补充申请获国家药品监督管理局(NMPA)批准。此项批准主要是基于公司在中国、美国和日本的临床药理学数据。此次新的用法用量的获批将大幅减少药品使用频率,提高患者用药便捷性,给肿瘤患者更好的治疗选择。思路迪医药坚持以患者为中心的理念,不断探索更优的给药方案,践行帮助肿瘤患者活得更久更好的美好愿景。
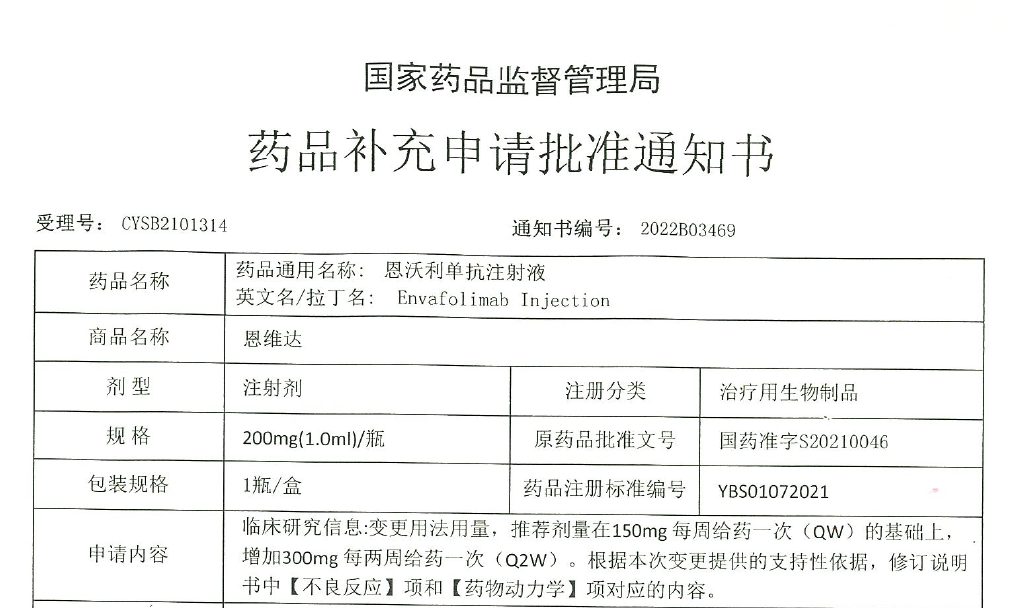
本次新增的剂量用法方案,与此前恩维达®的推荐剂量及用法“150mg每周给药一次”相比,有着相似的药代谢动力学,安全性和有效性特征。此次补充申请的获批,可以在保证恩维达®临床疗效的前提下,给予患者更多的治疗方案选择。对于医生来说,用药方案更加灵活,可根据患者实际情况选择单周给药抑或双周给药,提高医疗资源的使用效率;对于患者而言,将提升药物使用的便捷性,直接减少用药和就医频率,显著改善生活质量。
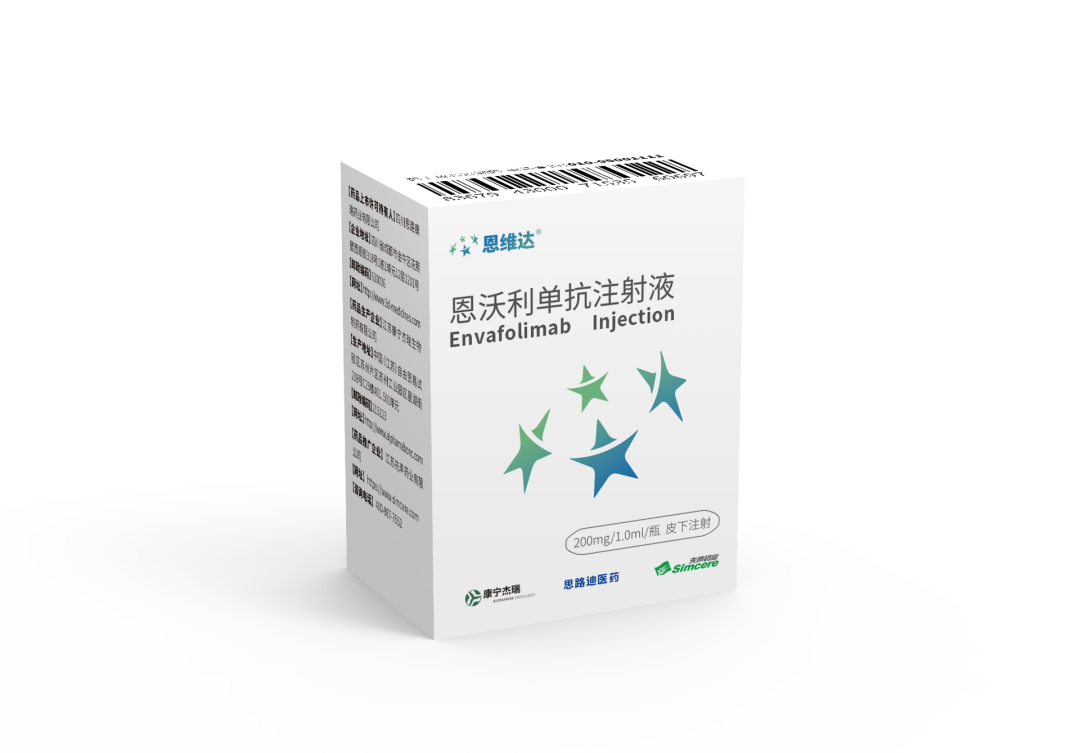
恩维达®是全球首个且唯一上市的皮下注射PD-1/PD-L1抗体药物,也是中国首个获批的泛瘤种适应症(MSI-H/dMMR)免疫治疗药物。恩维达®具有与进口PD-(L)1药物相当的疗效,且较同类药物在安全性、便利性和依从性方面具有独特优势,患者无需进行长达30 分钟以上的静脉滴注,而是只需要30秒内完成皮下注射用药,极大地提升了用药体验、降低了医疗成本。除临床治疗上的快捷与便利,恩维达®在疗效上也得到了中国临床肿瘤学会(CSCO)的认可,已进入《CSCO胃癌诊疗指南2022版》(Ⅰ级推荐,2A类证据)、《CSCO结直肠癌诊疗指南2022版》(Ⅱ级推荐,2A类证据)、《CSCO免疫检查点抑制剂临床应用指南2022版》(I级推荐,2A类证据)。恩维达®已在中国惠及超过10000名肿瘤患者,并正在开展超过15项单药及药物联用的临床试验,其中在美国开展的治疗软组织肉瘤和在中国开展的治疗胆管癌等研究已进入注册/临床III期,相信未来将继续给患者带来更多更优质的治疗选择。
关于恩维达®
恩维达®基于其独特设计,在安全性、便利性、依从性方面具有优势,患者无需进行静脉滴注,同时有望降低医疗成本。目前在中国、美国和日本针对多个肿瘤适应症同步开展临床试验,多个适应症已进入注册/Ⅲ期临床。恩维达®已被美国FDA授予晚期胆道癌孤儿药资格、软组织肉瘤孤儿药资格。2021年11月,恩维达®正式在中国率先获批上市,适用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗,包括既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者以及既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。
关于思路迪医药(3D Medicines Inc.)
思路迪医药是一家进入商业化阶段专注肿瘤治疗领域的创新药公司,秉承“帮助肿瘤患者活得更久更好”的愿景,针对肿瘤治疗慢病化趋势开发新一代抗肿瘤药物。公司产品线包括12款具有差异化临床价值或全球领先的创新药,其中8款已进入临床开发或商业化阶段,包括全球首个皮下注射PD-L1单域抗体新药恩维达®已获国家药品监督管理局批准上市销售;引进first-in-class多肽肿瘤疫苗3D189和GAS6/AXL抑制剂3D229已进入全球III期临床研究;自主研发的多靶点激酶抑制剂3D011也进入了临床开发阶段,临床前品种包括国际领先的双抗CD3xPD-L1等。公司建立了完善的创新药研发平台,涵盖肿瘤靶点验证、药物发现、生物标志物开发以及临床开发等。公司逾200人的国际化团队,具有从药物发现、临床前研究、临床开发、申报上市及商业化的成功经验,多个适应症已获得FDA及NMPA孤儿药认证或优先审评。思路迪医药秉承以临床价值为中心,为全球肿瘤患者开发更优的肿瘤治疗药物。
更多信息请访问:
http://www.3d-medicines.com
思路迪医药前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有关于或引用的本公司及董事的陈述、观点或意愿乃本文章刊发日期作出,可能因未来发展而出现变动。
热门文章

请咨询我们