恩维达®TMB-H适应症纳入突破性治疗品种
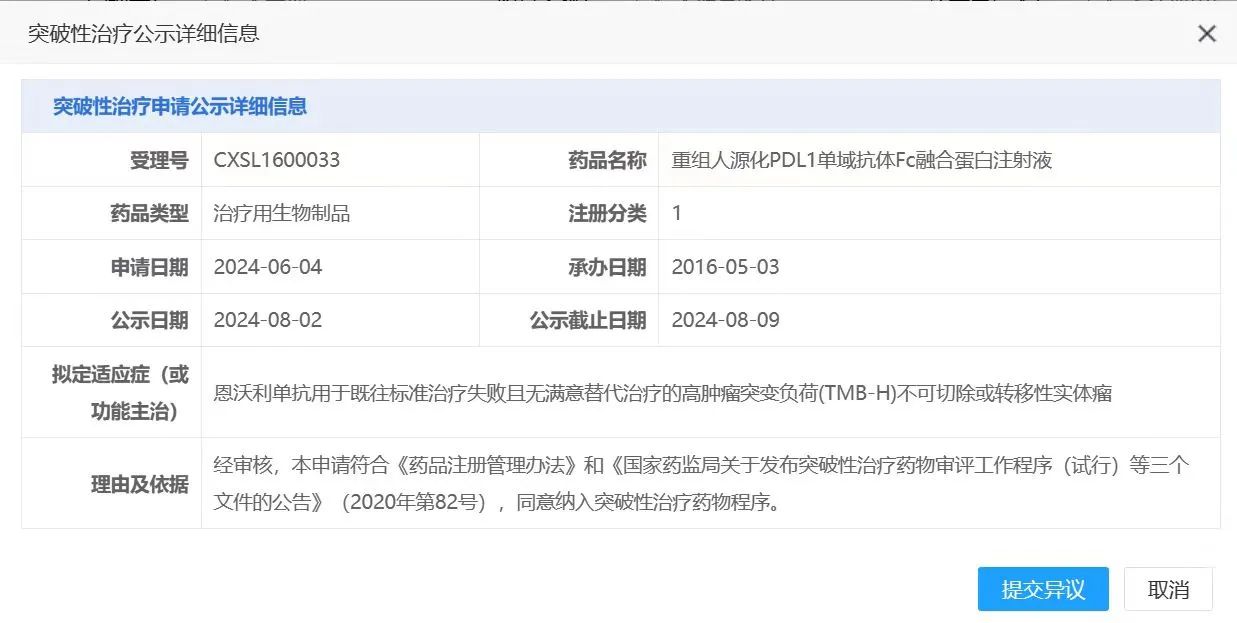
近期,国家药品监督管理局药品审评中心(CDE)公示显示,思路迪医药股份有限公司(3D Medicines, 1244.HK)旗下商业化产品恩维达®(恩沃利单抗注射液)纳入突破性治疗品种,用于既往标准治疗失败且无满意替代治疗的高肿瘤突变负荷(TMB-H)不可切除或转移性实体瘤。该适应症属于严重危及生命的疾病,目前中国尚无获批的标准治疗方案。近年来,美国FDA批准的“不限癌种”新药项目中,高肿瘤突变负荷(TMB-H)是被使用的生物标志物之一。
肿瘤突变负荷(TMB)是近年来在多种肿瘤免疫治疗中发现的可用于预测免疫治疗疗效的独立生物标记物。2018年,Johns Hopkins 研究所的科学家在《新英格兰医学杂志》上发表的一篇通讯文章中,研究证实了肿瘤突变数量越多,免疫治疗效果越好,超过一半(55%)的癌症对免疫检查点抑制剂的响应效果可以通过TMB来解释。
恩维达®作为靶向PD-L1的免疫检查点抑制剂可以解除肿瘤对免疫细胞的抑制,增强人体免疫系统发现和消灭癌细胞的能力。而对于高肿瘤突变负荷的患者而言,体细胞突变产生了多种新抗原,为T细胞提供了丰富的潜在攻击靶点,这会使得靶向PD-1/PD-L1的免疫检查点抑制剂疗法对这类肿瘤有更好的效果。目前,有资料显示在TMB-H肿瘤患者中,最常见的肿瘤类型是小细胞肺癌(34.3%),宫颈癌(16.2%),子宫内膜癌(15.2%)和肛门癌(14.1%)。
恩维达®本次纳入突破性治疗药物程序后,药审中心将为其将在临床试验期间的首次沟通交流、安全性/重大技术问题相关会议、关键临床阶段会议及技术问题咨询等方面优先配置资源,持续为申请人提供对于研究方案及申报资料等方面的建议,保障临床试验顺利进行,有望加速恩维达®在该适应症上的获批上市进度,提早为患者带来新的临床选择。
关于恩维达®(恩沃利单抗注射液)
恩维达®(恩沃利单抗注射液)由康宁杰瑞自主研发,2016年起与思路迪医药共同开发,2020年3月30日,康宁杰瑞、思路迪医药、先声药业三方达成战略合作,康宁杰瑞作为原研方负责生产和质量,思路迪医药负责肿瘤领域的临床开发,先声药业负责产品在中国大陆的独家商业推广。
基于其独特设计,恩维达®在有效性、安全性、便利性、依从性方面具有优势,患者无需进行静脉滴注,同时有望降低医疗成本。目前在中国、美国和日本针对多个肿瘤适应症同步开展临床试验,多个适应症已进入注册/Ⅲ期临床。恩维达®已被美国FDA授予晚期胆道癌孤儿药资格、软组织肉瘤孤儿药资格。2021年11月,恩维达®正式在中国率先获批上市,适用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗,包括既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者以及既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。
关于思路迪医药(3D Medicines Inc.)
思路迪医药股份有限公司(1244.HK)是一家进入商业化阶段专注肿瘤慢病化治疗领域的创新药公司,秉承“帮助肿瘤患者活得更久更好”的愿景,研发新一代抗肿瘤药物。公司产品线包括12款具有差异化临床价值或全球领先的创新药,其中8款已进入临床开发或商业化阶段,包括全球首个皮下注射PD-L1单域抗体新药恩维达®已获国家药品监督管理局批准上市销售;依托公司自有mRNA研发平台和肿瘤基因组大数据AI分析平台,研发系列mRNA产品;公司自主研发的多靶点激酶抑制剂3D011也进入了临床开发阶段,临床前品种包括国际领先的CD3xPD-L1双特异性抗体。公司建立了从药物发现、临床前研究、临床开发、申报上市及商业化能力。思路迪医药坚持以患者为中心,开发具有差异化临床价值的创新药。
更多信息请访问:
http://www.3d-medicines.com
思路迪医药前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有关于或引用的本公司及董事的陈述、观点或意愿乃本文章刊发日期作出,可能因未来发展而出现变动。
热门文章

请咨询我们