思路迪医药 CD47 抗体新药 3D197 临床试验申请获 NMPA 批准
2022年1月7日,思路迪医药(3D Medicines Inc.,简称“思路迪医药”)宣布其第8个临床阶段候选药物3D197注射液临床试验获得中国国家药品监督管理局(NMPA)临床试验批准通知书。3D197为新一代靶向CD47的全人源化IgG4单克隆抗体,属于生物药品创新药,在境内外均未上市。

本次获批为3D197中国首次I期临床试验,随后将开展Ib/II期研究以评估3D197与恩沃利单抗、阿扎胞苷、利妥昔单抗及其他联用疗法治疗实体瘤及血液恶性肿瘤的疗效。
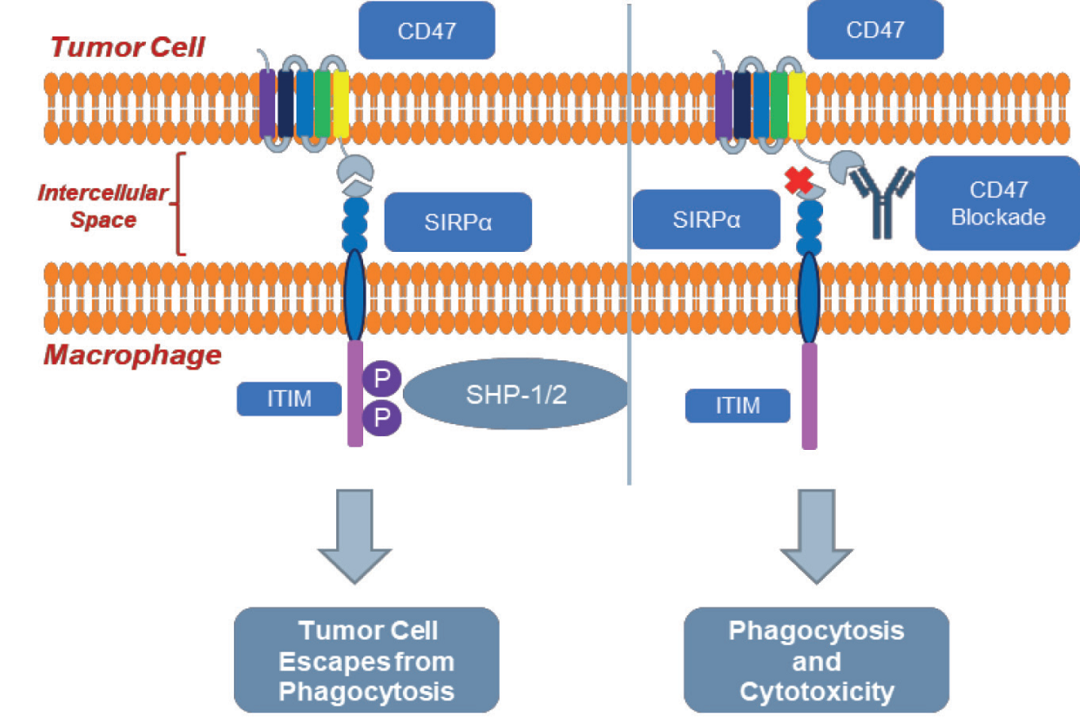
CD47抗体可阻断CD47-SIRPα相互作用,以促进巨噬细胞对癌细胞的吞噬作用。根据临床前试验结果,3D197以高亲和力与人源CD47结合,可最大限度提高疗效,不引起贫血相关毒性反应。未引起体外红细胞凝集,临床前毒理实验也未引起贫血。3D197有望成为安全性更好的新一代CD47抗体新药,阻止“别吃我信号”,从而增强巨噬细胞对肿瘤的吞噬作用。下图显示3D197的作用机制:
关于 3D197(IMC-002)
3D197(IMC-002)是处于全球 I 期临床开发的全人源化IgG4单克隆抗体新药,通过阻断CD47-SIRPα相互作用,促进巨噬细胞对肿瘤细胞的吞噬作用。现有临床前数据表明,IMC-002与人CD47亲和力强,可以最大限度地提高疗效,而不会出现与红细胞结合或引起贫血等其他在研CD47抑制剂常见的副作用。
有关IMC-002 I期临床试验(NCT04306224)结果的更多信息,请访问:ClinicalTrials.gov
关于思路迪医药(3D Medicines Inc.)
思路迪医药是一家进入商业化阶段的专注肿瘤治疗领域的医药公司,秉承“帮助肿瘤患者活得更久更好”的愿景,结合肿瘤治疗慢病化的未来趋势,为全球肿瘤患者开发肿瘤药物。公司产品线包括12款具有临床价值且差异化或全球领先的创新候选药物,其中8款已进入临床开发或商业化阶段,包括注射PD-L1单域抗体新药恩维达®已获国家药品监督管理局附条件批准在中国上市;引进多肽肿瘤疫苗3D189和GAS6/AXL抑制剂3D229已获FDA批准开展全球III期MRCT临床研究;自主研发的多靶点激酶抑制剂3D011也进入了临床开发阶段,另外4款产品分别靶向FGFR123\EP4\COX2\CD47也在国内外进入临床阶段。临床前品种还包括国际领先的双抗CD3xPD-L1。公司目前拥有逾250人的新药研发、生产和商业化的国际化团队,为全球肿瘤病人探索更优的疗法。
更多信息请访问: http://www.3d-medicines.com
关于 ImmuneOncia
ImmuneOncia是一家聚焦肿瘤免疫领域的生物制药公司,由Yuhan Corporation与Sorrento Therapeutics结合双方在药物开发和抗体工程方面的专业优势于2016年合资成立。公司的使命是为全球肿瘤患者带来安全和有效的创新免疫疗法,产品线包括处于II期临床研究的抗PD-L1抗体IMC-001和处于I期临床研究的抗CD47抗体IMC-002等多个免疫检查点抑制剂。2021年3月,ImmuneOncia公司将IMC-002大中华区独家权益授予思路迪医药。
如需更多信息,请浏览:www.immuneoncia.com
思路迪医药前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有关于或引用的本公司及董事的陈述、观点或意愿乃本文章刊发日期作出,可能因未来发展而出现变动。
热门文章

请咨询我们