国内首个AXL抑制剂抗体新药临床试验申请获CDE受理
2021年3月6日,思路迪医药(3D Medicines Inc.)宣布,AXL抑制剂(GAS6饵蛋白融合蛋白)3D229注射液的临床试验申请已于日前获国家药品监督管理局药品审评中心(CDE)正式受理,受理号为CXSL2100078,这是该类产品在国内的首个临床申报。3D229(又名:AVB-500)系美国Aravive公司的核心抗癌品种,2020年11月11日,思路迪医药从Aravive处获得该品种在大中华区肿瘤领域的开发及商业化的独家授权。3D229注射液临床试验申请正式获得受理,标志着思路迪医药在顺应肿瘤慢病化趋势、构建差异化优势和极具市场竞争力的产品布局的道路上又迈出了坚实一步。
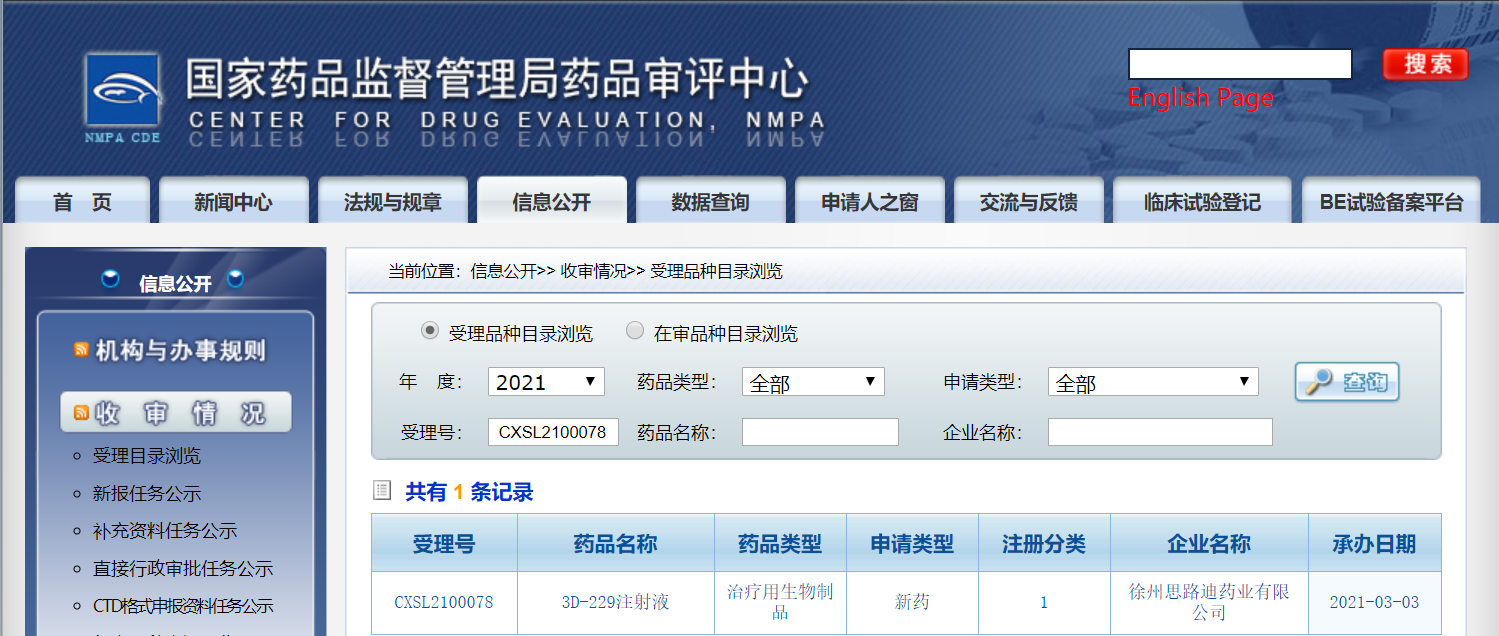
3D229注射液临床试验申请受理信息
3D229是特异性针对GAS6的高亲和力Fc融合蛋白,也是一种新型GAS6-AXL信号通路抑制剂。GAS6-AXL信号通路是促进肿瘤生长及转移、肿瘤免疫逃逸与药物耐受的关键通路。AXL及其配体GAS6在许多恶性肿瘤中都有高表达和活化:如急性髓系白血病(AML),肾癌,胰腺癌,乳腺癌,肺癌,卵巢癌以及前列腺癌等。GAS6-AXL信号通路抑制剂与免疫治疗检查点抑制剂、放疗或化疗的联用均可实现对肿瘤的良好控制,因此,GAS6-AXL信号通路是当前肿瘤治疗领域的重要突破口之一,可望成为与PD-1/L1联用的重磅药物,具有极高临床价值和巨大市场空间。
自2020年10月以来,思路迪医药先后引进了包括3D229在内的5款创新药产品,加速扩充其在研管线,目前已初步形成了以肿瘤免疫治疗创新药为核心、新一代疼痛管理药物为辅助的全方位管线布局。2020年11月11日获得3D229在大中华区肿瘤领域的临床开发及商业化的独家授权之后,思路迪医药更是全力推进3D229临床研究试验的各项申报准备工作;仅花了不到四个月时间就完成了从项目引进到临床试验申请获得受理的全过程,思路迪医药团队对于抗肿瘤创新药发展方向的精准把握能力以及对于引进项目的快速转化能力再一次得到完美体现。
思路迪医药董事长兼首席执行官龚兆龙博士表示:“继全球首个皮下注射PD-L1抗体新药恩沃利单抗(Envafolimab)注射液上市申请被纳入优先审评、公司首个自主研发药物3D011临床试验获批之后,我们非常高兴看到3D229临床试验申请获得正式受理,开创了国内同靶点药物申报临床的先河。思路迪医药会进一步推进新一代肿瘤免疫治疗药物的研发,为全球肿瘤患者提供更多更优的治疗选择,帮助肿瘤患者活得更久更好。”
关于思路迪医药
思路迪医药是一家处于晚期临床开发及早期商业化布局阶段的生物医药公司,秉承“帮助肿瘤患者活得更久更好”的理念,针对肿瘤治疗慢病化的未来趋势,专注为全球癌症患者开发差异化的新一代肿瘤免疫治疗药物,延长肿瘤患者的生存时间,改善患者生活品质。公司产品线包括新一代生物大分子药物和小分子化学药物,并拥有一支具有国际化新药研发、注册和商业化运营能力的团队。
更多信息请访问:
http://www.3d-medicines.com
思路迪医药前瞻性声明
本文所作出的前瞻性陈述仅与本文作出该陈述当日的事件或资料有关。除法律规定外,于作出前瞻性陈述当日之后,无论是否出现新资料、未来事件或其他情况,我们并无责任更新或公开修改任何前瞻性陈述及预料之外的事件。请细阅本文,并理解我们的实际未来业绩或表现可能与预期有重大差异。本文内所有关于或引用的本公司及董事的陈述、观点或意愿乃本文章刊发日期作出,可能因未来发展而出现变动。
热门文章

请咨询我们