思路迪医药皮下注射PD-L1抗体KN035的临床试验数据在2019年CSCO学术年会发布
2019年9月19日,思路迪医药参与第22届全国临床肿瘤学大会暨2019年CSCO学术年会,并由日本国立肿瘤研究所中央医院Toshio Shimizu教授口头报道了思路迪医药皮下注射抗PD-L1单域抗体Envafolimab (KN035)在日本晚期实体瘤患者中的1期临床试验(NCT03248843)阶段性数据,具体展示信息如下:
口头报道
论文题目:Phase I Study of Envafolimab (KN035), the First Subcutaneously Administered, Novel Fusion Anti-PD-L1 Antibody in Japanese Patients with Advanced Solid Tumors
讲者:Toshio Shimizu, M.D., PhD.
时间:2019年9月19日(16:25-16:35)
地点:抗肿瘤药物安全管理专场Session 3 2层 国宴3厅 厦门国际会议中心

以下为本次数据发布的详细信息:
研究背景
Envafolimab (KN035)是我国自主研发,全球首个人源化抗PD-L1单域抗体和人IgG1 Fc的新型融合蛋白,与目前已经上市和在研的PD-1/PD-L1抗体相比有明显的差异化的优势。Envafolimab具有可皮下注射、室温下稳定、肿瘤穿透速度快等优点,从而提高肿瘤患者用药依从性,改善患者生活质量,符合未来将肿瘤作为慢性病长期管理的趋势。目前为止,Envafolimab在美国、日本和中国同步I期临床试验进展顺利,在多线治疗失败的实体瘤患者中表现出良好的安全性及初步疗效。
本次CSCO会议上,我们公布的是一项在日本开展的针对晚期实体瘤患者的I期、开放性的剂量递增和剂量扩展研究,旨在评估Envafolimab的安全性、耐受性、药代动力学(PK)特征和初步抗肿瘤疗效。
研究方案及数据概述
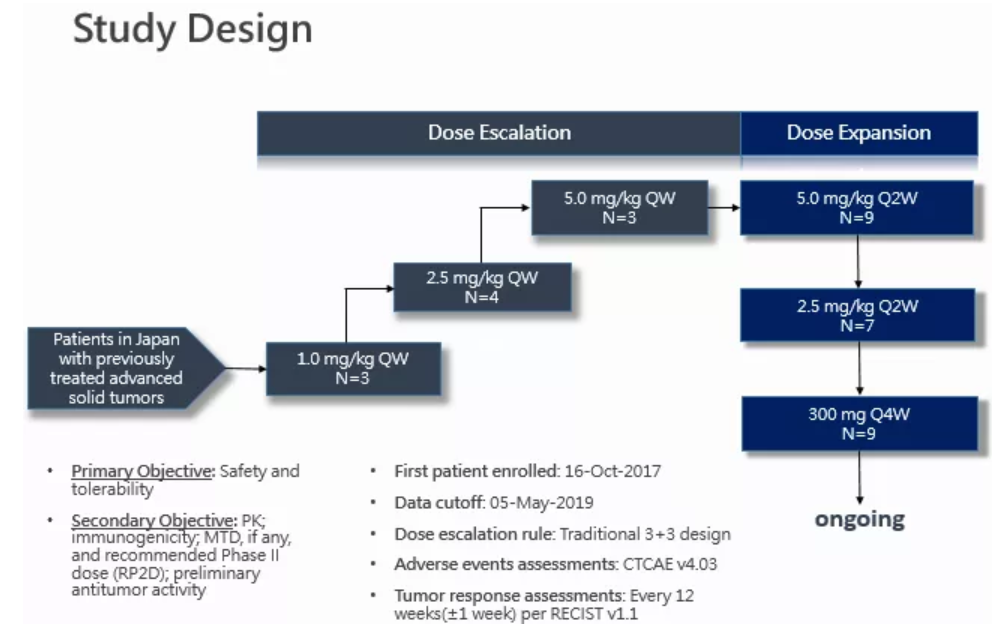
该项研究为评估皮下注射Envafolimab单药治疗日本晚期实体瘤患者安全性、耐受性、药代动力学特征和初步疗效的剂量递增和剂量扩展I期临床研究。主要纳入标准为经组织学或细胞学确认的晚期实体瘤、经标准治疗失败或不可耐受、不适合手术及局部治疗、ECOG 0-1分、有足够的造血和器官功能。
剂量递增阶段设计为传统“3+3”剂量爬坡试验,给药剂量分别为1.0, 2.5, 5.0 mg/kg,每周一次 (QW),皮下注射,剂量限制性毒性(DLT)观察期在第一周期(首次给药后28天内),剂量爬坡将持续到出现最大耐受剂量(MTD),并确定后期临床试验推荐剂量。剂量扩展阶段分为2.5, 5.0 mg/kg,每两周一次 (Q2W),以及300mg 固定剂量,每四周一次 (Q4W),皮下注射,将进一步在局部晚期或转移性实体瘤患者中探索安全性、PK和初步疗效。300 mg 固定剂量组正在入组,暂无结果。
首例受试者于2017年10月16日接受首次给药,截至2019年5月5日,该试验共入组26例晚期实体瘤患者(剂量递增阶段10例,剂量扩展阶段16例),包括4例胆道癌、3例软组织肉瘤、2例尿路上皮癌、2例卵巢癌、2例结肠癌、2例胰腺癌和11例其它晚期实体瘤患者。患者中位年龄59岁,男性占42.3%,接受过二线及以上治疗的患者占88.5%。至数据截止日期,有23例患者已退出研究(21例因疾病进展退出),有3例仍在继续用药。试验使用实体瘤疗效评价标准1.1版(RECIST v1.1)评价临床疗效,每12周评价一次,共12例患者接受过至少一次的基线后肿瘤疗效评价。
研究结果
安全性结果
各剂量组均未观察到剂量限制性毒性,且未达到最大耐受剂量。
不论与药物的相关性和严重程度,最常见的不良事件有:发热(19.2%)、淋巴细胞计数降低(15.4%)、皮肤瘙痒(15.4%)、皮疹(15.4%)、头痛(15.4%)、呕吐(11.5%)。被认为与研究药物相关的最常见不良事件有:发热(11.5%)、皮肤瘙痒(11.5%)和皮疹(11.5%),均为1-2级。没有患者发生5级药物相关不良事件。有1例5.0 mg/kg Q2W剂量组患者发生3级药物相关严重不良事件(脑梗塞,可能相关);1例2.5 mg/kg Q2W剂量组患者发生2级药物相关严重不良事件(皮疹,已缓解),经研究者判断为免疫介导的不良反应。
总体上,从目前日本1期的安全性数据看,Envafolimab的安全性可控。
初步有效性结果
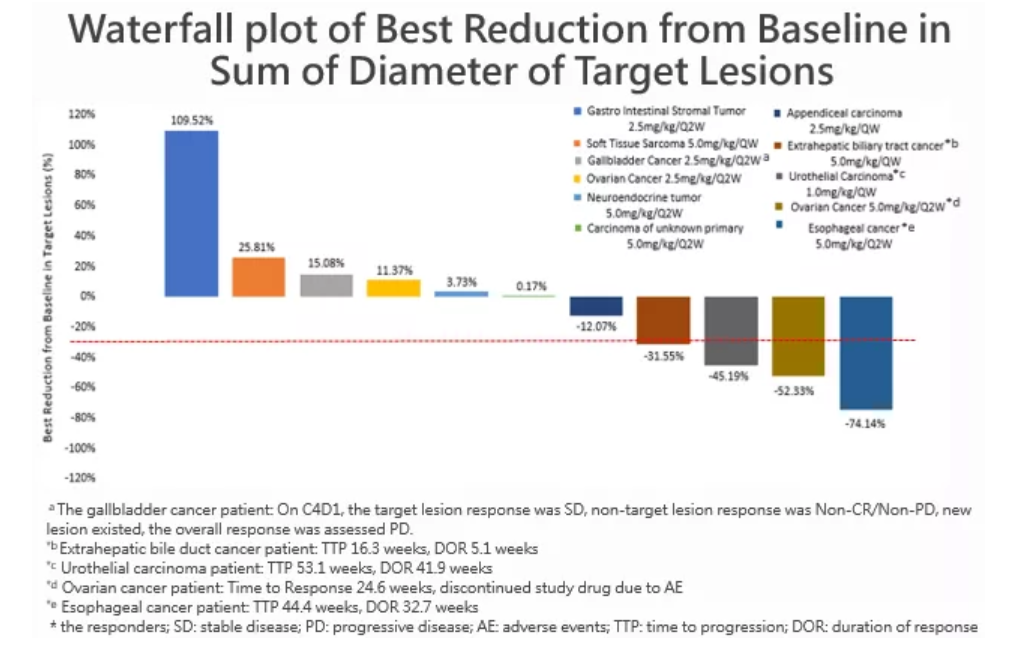
截至2019年5月5日,在12例接受疗效评估的患者中(如下图,瀑布图中共11例,有1例基线时无靶病灶),4例患者观察到最佳疗效为部分缓解(PR),其中3例(25.0%)经过疗效确认,所有PR患者包括1例食管癌、1例卵巢癌均来自5.0mg/kg Q2W剂量组,食管癌疾病进展时间(TTP)44.4周、缓解持续时间(DOR)32.7周,卵巢癌肿瘤响应时间(TTR)24.6周,因不良事件退出研究;1例尿路上皮癌来自1.0 mg/kg QW剂量组,TTP 53.1周、DOR 41.9周;1例肝外胆管癌(未经疗效确认)来自5.0 mg/kg QW剂量组,TTP 16.3周、DOR 5.1周。这4例PR,除上述卵巢癌患者外,均在用药后12周第一次疗效评估时出现了明显的肿瘤退缩。
5例(41.7%)患者观察到最佳疗效为疾病稳定(SD),包括1例尿路上皮癌来自1.0 mg/kg QW剂量组(基线时无靶病灶,研究者评价最佳疗效为SD),已完成19个周期的治疗,至数据截止日期,该患者仍在接受治疗;1例阑尾癌来自2.5 mg/kg QW剂量组,1例卵巢癌来自2.5 mg/kg Q2W剂量组,1例神经内分泌肿瘤、1例来源不明恶性肿瘤均来自5.0 mg/kg Q2W剂量组,这4例患者SD中位持续时间为11.5周。
本研究的受试者多数都经过了2线及以上治疗,治疗选择很少,预后较差,在这些未经生物标记物选择的晚期实体瘤患者中,给予Envafolimab单药治疗,在疗效可评估人群的总体客观缓解率(ORR)为25.0%,疾病控制率(DCR)达到66.7%,显示了较好的临床疗效,在部分患者中看到了对治疗产生了持久的高反应性,表明Envafolimab可能提供了一种新的、有前景的治疗选择。
药代动力学特征
初步PK分析表明(如下图),Envafolimab有很好的稳定性,半衰期较长,支持后续临床试验采用较少频次的给药方案。不管是QW还是Q2W给药方案,Envafolimab的体内暴露量与剂量表现出了良好的相关性,随剂量的增加而增大。
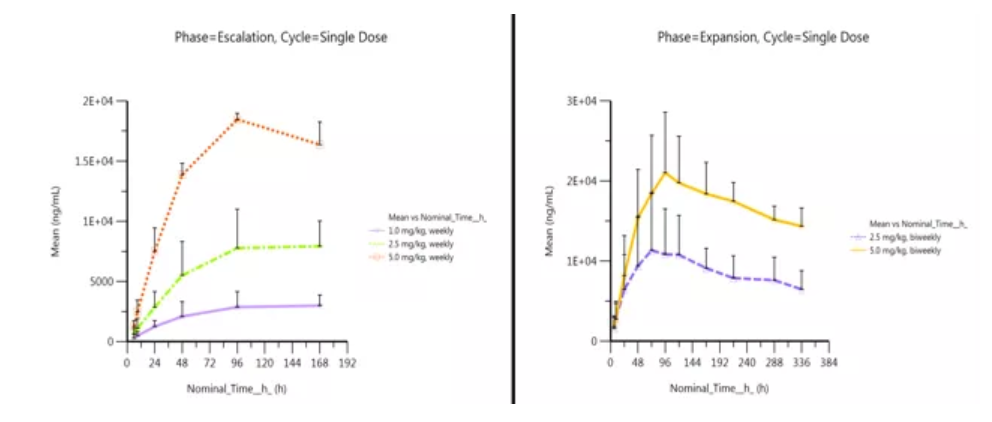
左:剂量递增阶段患者单次QW给药后血清中KN035的平均药物浓度-线性时间曲线图(Mean+SD)
右:剂量扩展阶段患者单次Q2W给药后血清中KN035的平均药物浓度-线性时间曲线图(Mean+SD)
结论
Envafolimab单药在治疗日本多种晚期实体瘤患者中安全性及耐受性良好,在所有剂量水平下均未观察到DLT,未达到MTD,表现出令人期待的抗肿瘤活性和持续缓解。基于每2周用药的PK数据,目前正在评估每4周固定剂量给药这种较少频率的给药方案。
总体来看,Envafolimab (KN035)作为全球首个皮下注射抗PD-L1单域抗体,安全性及初步疗效与其他公司静脉给药的同类产品结果一致,药效强,维持时间长,临床使用方便。鉴于理想的I期数据,Envafolimab目前正在国内开展一项MSI-H实体瘤Ⅱ期和一项胆道癌Ⅲ期的注册性临床研究。
热门文章

请咨询我们