2020 ASCO发布皮下注射PD-L1抗体Envafolimab(KN035)的最新研究结果
2020年5月29日,中国北京,思路迪医药(3D Medicines),一家专注于开发针对癌症患者的下一代差异化免疫肿瘤药物的临床阶段的生物医药公司,今天在美国临床肿瘤学会(ASCO) 2020年会上公布了皮下注射PD-L1抗体Envafolimab(KN035)的最新研究结果,该研究结果的题目为《Envafolimab(KN035)单药在高微卫星不稳定性(MSI-H)肿瘤/错配修复功能缺陷(dMMR)晚期实体瘤临床试验数据》。在完成至少两次基线后肿瘤评估的患者中,单药Envafolimab在50例既往接受了氟尿嘧啶类、奥沙利铂和伊立替康治疗的MSI-H/dMMR结直肠癌患者(39例)和至少经过一次系统性治疗失败的晚期胃癌患者 (11例)的 ORR为30%。与FDA已上市PD1抑制剂Keytruda及Nivolumab在同适应症获批数据高度一致。
Envafolimab(KN035)为全球首个皮下制剂PD-L1抗体,常温稳定,节约患者用药时间,提高患者依从性,显著改善患者生活质量,与目前已经上市和在研的PD-(L)1抗体相比给药方式优势明显,也是未来实现肿瘤作为慢性病管理的重要希望。
错配修复缺陷的晚期实体瘤
研究题目:Envafolimab(KN035) in advanced tumors with mismatch-repair deficiency
摘要号:3021;Clinical trial注册号: NCT03667170
发布时间:
2020年5月29日,8:00 AM - 11:00 AM (美国时间)
2020年5月29日,8:00 PM - 11:00 PM (北京时间)
研究背景:该开放标签关键II期研究评估了KN035在晚期MSI-H/dMMR癌症患者中的安全性和抗肿瘤活性。
研究方法:该研究是探索Envafolimab治疗MSI-H/dMMR晚期实体瘤的一项关键临床试验,采用单臂开放标签设计,研究主要终点为独立审评委员会评价的经确认客观缓解率(ORR)。结直肠癌(CRC)和胃癌(GC)的MSI-H/dMMR状态采用中心实验室确认,其他肿瘤采用当地实验室评估结果。详见下图:
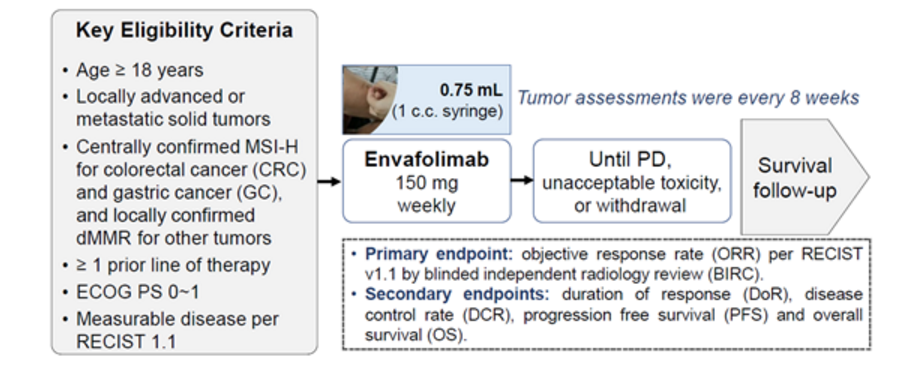
研究结果:截止到2019年12月17日,中国25个中心招募了103名MSI-H / dMMR晚期癌症患者。主要疗效人群(PEPi)包括39例既往至少接受过含氟尿嘧啶类、奥沙利铂和伊立替康方案治疗的晚期CRC和11例既往至少接受过一线标准治疗的晚期GC,中位随访时间为7.5个月。总体人群包括65例CRC(24例先前接受过氟尿嘧啶和奥沙利铂或伊立替康治疗),18例胃癌和20例其他瘤种,中位随访时间为6.7个月。主要亮点包括:
PEPi人群中经确认的客观缓解率为30%(95%CI:17.9%,44.6%),80%的缓解在数据截止时仍在持续。
先前接受氟尿嘧啶和奥沙利铂或伊立替康治疗的CRC患者中为54.2%(95%CI:32.8%,74.4%),84.6%的缓解在数据截止时仍在持续。
总体人群经确认的客观缓解率为34.0%(95%CI:24.9%,44.0%),85.7%的缓解在数据截止时仍在持续。
主要疗效指标
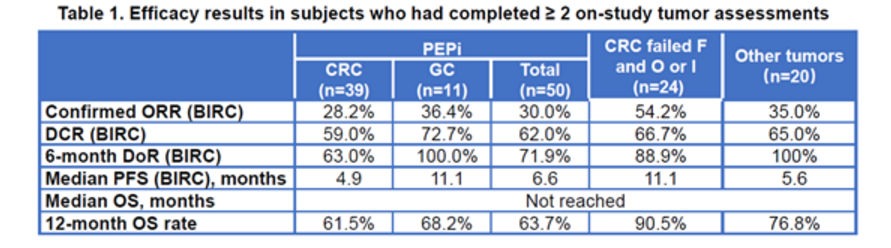

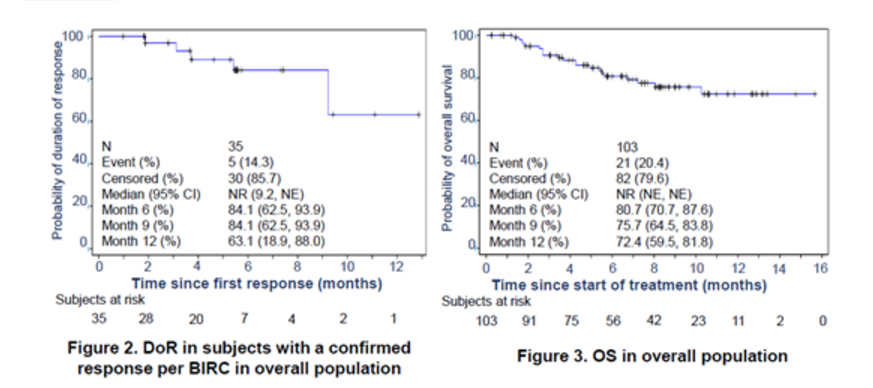
PEPi和总体人群的中位无进展生存期均为6.6个月。两个人群中位总生存均未达到。14名患者(13.6%)发生3–4级与治疗相关的不良事件(TRAE)。没有5级TRAE、肺炎或结肠炎的报道。9例患者发生了局部注射部位反应,均为1级或2级。
药物相关不良事件
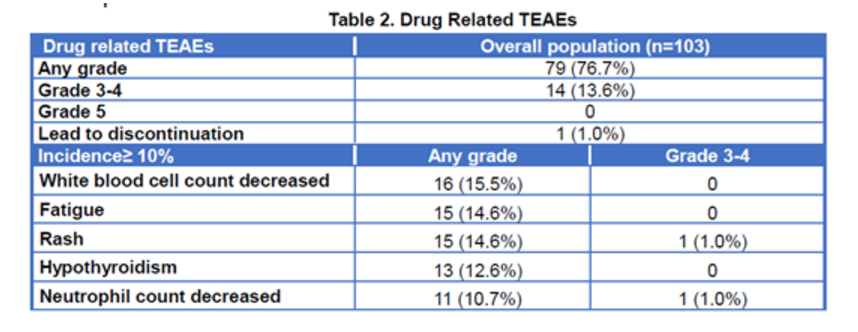
研究结论:Envafolimab在复治的晚期MSI-H/dMMR癌症患者中显示了持久的抗肿瘤活性和可控的安全性。
关于KN035
Envafolimab(KN035)是康宁杰瑞自主研发的PD-L1单域抗体Fc的融合蛋白,基于其独特设计,在安全性、方便性、依从性方面具有优势,可用于不适合静脉输液的患者,同时具有较低的医疗成本。2016年2月康宁杰瑞与思路迪医药达成合作开发协议,康宁杰瑞作为原研方负责生产和质量,思路迪医药负责肿瘤领域的全球临床开发、注册以及商业化阶段全球市场开拓和销售。2020年3月30日,康宁杰瑞、思路迪医药、先声药业三方达成战略合作,先声药业负责产品在中国大陆的独家商业推广。
目前Envafolimab(KN035)已在中国、美国和日本针对多个肿瘤适应症同步开展临床试验,多个适应症已进入注册/Ⅲ期临床。Envafolimab(KN035)获得了美国FDA的晚期胆道癌孤儿药资格认定,计划2020年进行中国药品注册申报。
关于思路迪医药
思路迪医药是一家临床阶段的生物医药公司,秉承“以患者为中心”的理念,针对肿瘤治疗慢病化的未来趋势,专注于为全球癌症患者开发差异化的新一代肿瘤免疫治疗药物,以延长肿瘤患者的生存时间,改善患者生活品质。产品线包括新一代生物大分子药物和小分子化学药物。思路迪医药拥有一支经验丰富的国际化团队,有在全球开展早期和II/III期注册临床试验以及全球注册申报的经验和能力。
关于康宁杰瑞
康宁杰瑞生物制药是一家专注于研发、生产和商业化创新抗肿瘤生物大分子药物的生物制药公司。2019年12月12日,公司在香港联合交易所主板上市,股票代码:9966。康宁杰瑞生物制药在双特异性抗体及蛋白质工程方面拥有全面整合的研发和制造平台。公司高度差异化的产品管线由八种肿瘤候选药物组成,其中六个为全球领先的双功能抗体,四个产品在中国,美国,日本处于Ⅰ-Ⅲ期临床试验开发阶段。公司拥有异二聚体及混合抗体等多个具有自主知识产权的技术平台,以及成熟的符合中国,美国和欧盟cGMP标准的大规模生产能力。公司基于这些国际领先的蛋白质工程平台打造新一代多功能生物大分子新药,惠及中国和全球的患者。
关于先声药业
先声药业是中国领先的研发驱动型医药公司,拥有“转化医学与创新药物国家重点实验室”,聚焦肿瘤、神经、自身免疫等重大疾病领域,致力于让患者早日用上更好药物。凭借优异的商业化能力,其主要产品在中国保持领先的市场份额。先声药业秉持开放式创新的研发策略,与多家跨国药企成为战略合作伙伴,促进全球生命科学成果在中国的价值实现。
注:(1)北美地区软组织肉瘤的临床开发注册及商业化由Tracon 主导
热门文章

请咨询我们